研究内容
生活習慣病と環境因子・遺伝素因

多因子疾患と言われる生活習慣病や癌は、遺伝素因とともに環境栄養を含めた環境要因が発症に重要です(図1)。
胎児期の栄養環境や摂取する食物成分、化学物質などによりエピジゲノミックな変化が生じることにより、成人期の肥満症や生活習慣病の罹患性に影響を与える可能性が考えられます。ヒストンのメチル化などを介する遺伝子の後天的修飾であるエピジェネティックな遺伝子発現の制御が、細胞分裂を越えて保存され、一個体の間の細胞の記憶システムを形成していると推定されています。このことが肥満・生活習慣病の発症に大きな役割をはたしていることが明らかにされつつあります。
エピゲノムとは
哺乳類の細胞では、DNAは8分子のヒストンタンパク質に巻き付いてクロマチンという構造をとります。DNAメチル化や複数のヒストン修飾によって形成されるクロマチン高次構造がその付近の遺伝子の発現を規定します。例えばヒストンH3の9番目のアミノ酸リジン(H3K9と略される)がメチル化されると、この領域は閉鎖型のクロマチンとなり転写活性化因子がアクセスしにくい閉鎖型クロマチンとなり、遺伝子の転写活性化能は抑制されます。このように、 DNAの塩基配列の変化を伴わずに、遺伝子の発現を制御する仕組みをエピジェネティック機構といいます(図2)。エピジェネティックの機構はDNAのメチル化、ヒストンの翻訳後修飾、DNAとタンパク質の複合体であるクロマチンで成り立っており、このように修飾されたゲノムをエピゲノムと呼びます。
 エピジェネティックス- 塩基配列によらない遺伝子発現調節機構
エピジェネティックス- 塩基配列によらない遺伝子発現調節機構
(図2) ヒストンテールは、メチル化、アセチル化、リン酸化、ユビキチン化、SUMO化修飾を受ける。修飾パターンは、クロマチン構造の変化エフェクターの呼込みに関与する。
脂肪細胞分化とエピジェネティックス
脂肪細胞の分化においては、Peroxisome proliferator-activated receptor γ(PPARγ)とよばれる核内受容体型のリガンド応答性の転写因子は、マスターレギュレーターとも言われ、脂肪合成、脂肪取り込みなど、脂肪細胞の特徴をもたらす多くの遺伝子の転写制御をになうことが知られています(図3)。

(図3) 脂肪細胞のマスターレギュレーターPPAR はRXRとヘテロダイマーで作用する。
PPARγは脂肪細胞への分化誘導とともに発現してくる。
PPARγの活性化剤は、インスリン抵抗性の改善薬として糖尿病の治療に広く用いられています。 私たちはヒトの肥満・生活習慣病に代表される代謝疾患において、エピゲノムが制御するメカニズムの存在の可能性を見いだし、この仮説を検証するため、PPARγの標的遺伝子のゲノムワイド解析(ChIP on Chip)を行い、PPARγが複数のヒストンメチル化酵素遺伝子を標的とし、エピゲノム制御に関与することを明らかにしました(図4)。

(図4) ゲノム上のPPAR 結合DNAの系統的免疫分離
PPARγの標的遺伝子のChIP on Chip解析からは、1200個以上のPPARγの直接の標的遺伝子を同定し、その中から新たに、ヒストンのメチル化修飾を行う酵素の遺伝子発現を制御することを明らかにしました。PPARγによってヒストンH3の9番目のリジン(H3K9)のメチル化酵素は転写レベルで負に、ヒストンH4の20番目のリジン(H4K20)のモノメチル化酵素PR-Set7/Setd8は正に制御される標的遺伝子であることを見いだしました(図5)。
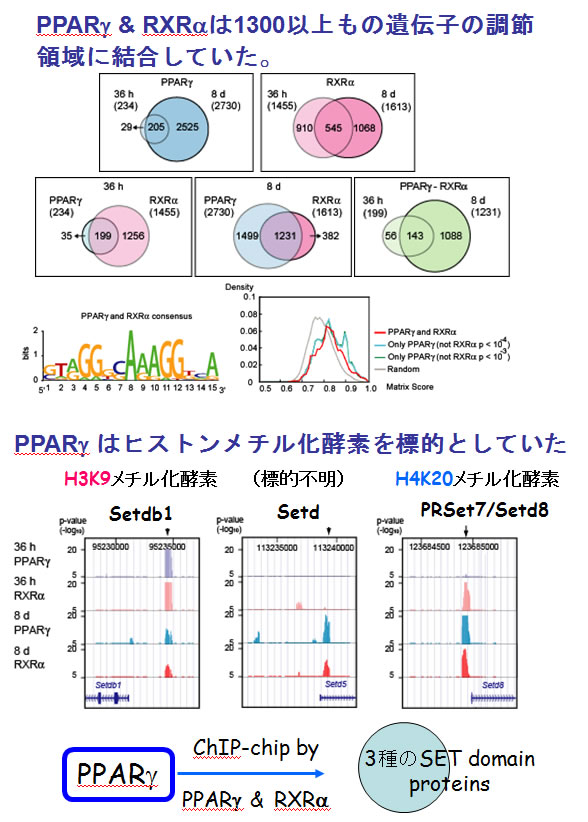
(図5)脂肪細胞分化のマスターレギュレーターPPAR と RXR のヘテロダイマーは、約1300以上もの遺伝子の調節領域に結合していた(3T3-L1 脂肪細胞)。そして重要なことにPPAR は3種類のヒストンメチル化酵素遺伝子の制御領域に結合していた。
PPAR によるエピジェネティックな制御 PPAR は、従来知られている転写因子としてのジェネティクな制御とともに、クロマチン構造を改変し、エピジェネティックな制御を行っていることを発見した。
さらに、細胞の中でこれらの遺伝子の発現を抑制させるRNAi干渉の実験から、H3K9トリメチル修飾は脂肪細胞分化抑制に、そしてH4K20モノメチル化は分化促進に働くことを明らかとしました(図6)。
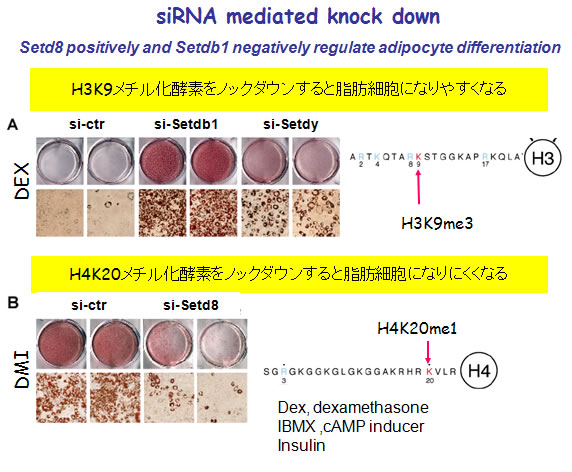
(図6) RNA干渉法による遺伝子ノックダウン
これらの知見はPPARγがこれらヒストン修飾酵素遺伝子の発現を制御し、脂肪細胞の分化をエピジェネティックスの角度から制御するという新たなコンセプトを打ち出しました(図7)。
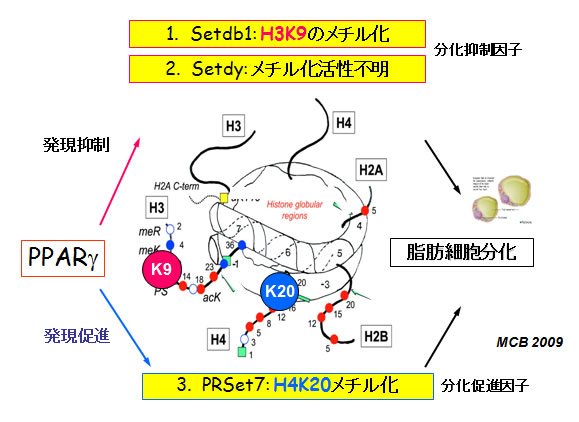
(図7)PPARγはヒストン修飾酵素遺伝子の発現制御を行うことでエピジェノミックな制御の役割を担う。
肥満・生活習慣病に関わる脱メチル化酵素JMJD1A
H3K9のメチル化が脂肪細胞分化に関与することから、H3K9の脱メチル化酵素Jhdm2a/Jmjd1aのノックアウトマウスを解析したところ、予想外にもこのマウスは顕著な肥満マウスとなりました(図8)。このマウスは通常食餌下で、肥満(野生型と比べ5ヶ月で30%程度増加)に高脂血症、耐糖能異常、高インスリン血症を呈し、人におけるメタボッリックシンドローム・生活習慣病とも言える表現型を示しました。栄養分が不足するとJMJD1aが誘導され脂肪が動員されますが、JMJD1Aが欠損したマウスは脂肪が動員されずに肥満となることが考えています。
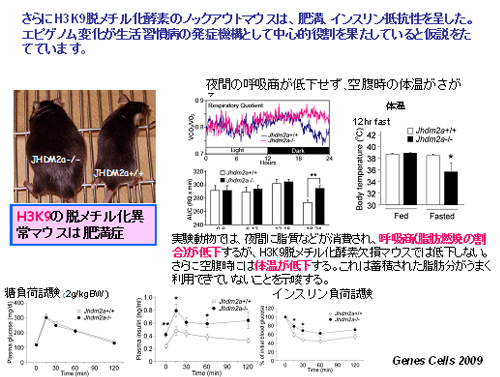
(図8) H3K9メチル化酵素欠損マウスは肥満・インスリン抵抗性を呈する(京都大学 眞貝洋一教授との共同研究)。
当研究室で目指す事
- 生活習慣病におけるエピゲノム標的の探索 エピゲノム標的の探索、60種のヒストンメチル化酵素、40種の脱メチル化酵素をゲノム配列から推定し、その発現プロファイルをデータベース化している。これらの酵素の発現、機能変化を系統的に探索し、治療標的を同定する。
- 生活習慣病にかかわるエピゲノムメカニズムの解明ヒストンのメチル化酵素、脱メチル化酵素が脂肪細胞を始めとするヒト細胞でどのように代謝を制御しているかを明らかにし、chip-seqおよびプロテオミクスを用いて酵素活性の測定方法を開発し、病変モデル、または病態サンプルで検証する。
- エピゲノム創薬我々の抽出した標的的酵素を発現し、結晶構造を解明し、ドッキングシミュレーションをもとに、低分子リード化合物をスクリーニングするエピゲノム創薬技術を応用し、生活習慣病の新規治療法を確立する。
